💡 【Nat.Methods】癌症转移、炎症调控新工具:光控技术提速近 6倍,实现单颗粒精度“印刷”细胞“信使”!
✨文章标题:Light-induced extracellular vesicle and particle adsorption ✉️作者:Eduardo Reátegui 等 🔗链接:https://doi.org/10.1038/s41592-025-02914-w
🎯 从“痛点”到“突破”:细胞信使研究的最后一公里
在人类健康与疾病的复杂网络中,细胞外囊泡(EVs)和颗粒(EVPs)——这些由细胞释放的微小脂质包裹——扮演着至关重要的“信使”角色。它们携带生物活性货物,在细胞间进行短距离和长距离通信,对疾病的动态发展,如癌症转移、血管生成和伤口愈合等,产生深远影响。过去二十年,EVPs的研究热情空前高涨,但大部分工作都集中在从生物液或细胞培养基中分离出来的EVP上。
然而,真正被低估、但可能更具决定性作用的EVPs,是那些附着在细胞外基质(ECM)上的颗粒。它们是细胞微环境(Microenvironment)的关键组成部分。想要完全揭示这些“基质结合型EVP”的奥秘,并开发出新的诊断或治疗方法,我们迫切需要一种无标记、可调控、可扩展且高分辨率的技术,能够像“印刷”电路板一样,精确地将这些微小颗粒图案化到表面上。
在此之前,缺乏一种通用且可控的平台,使得我们无法在体外精确模拟这些“基质结合型EVP”的自然状态,去研究它们如何影响细胞行为。例如,在细胞迁移过程中留下的“面包屑踪迹”——迁移体(Migrasome) ——虽然已经被发现,但我们没有可扩展的方法来精确地在体外“印刷”出这些踪迹,从而阻碍了对其功能和吞噬机制的深入理解。
现在,俄亥俄州立大学的科研团队带来了颠覆性创新,他们开发出一种名为光诱导细胞外囊泡和颗粒吸附技术(LEVA) 。这项技术不仅填补了这一空白,更以其强大的功能和高精度,开启了生物医学研究的新篇章。
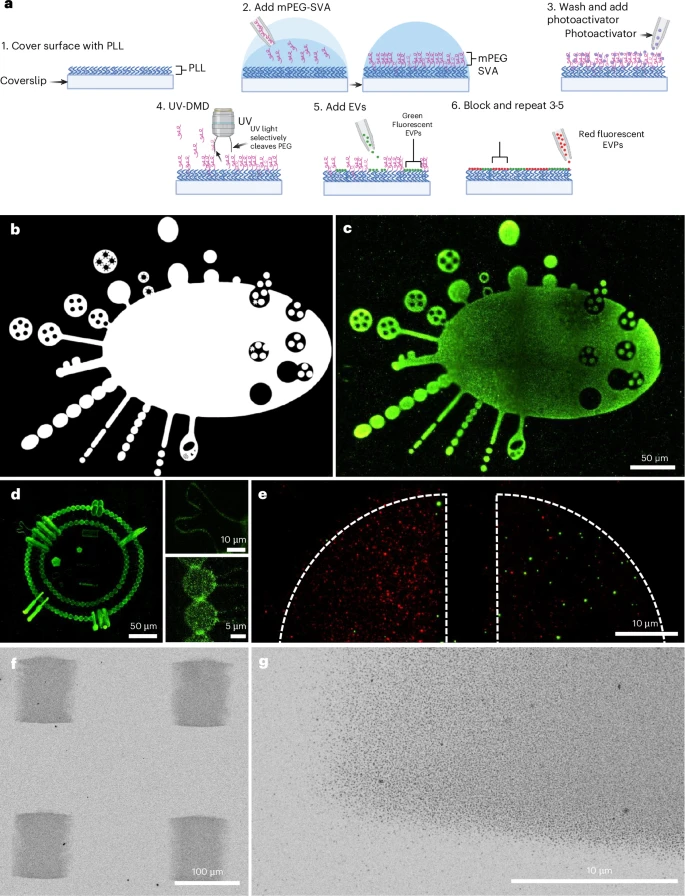
🔬 核心方法与技术细节:用“光刻”技术印制生命颗粒
LEVA技术的核心机制,是对一种已有的光诱导分子吸附技术进行了革命性的改造,使其适用于EVPs这类生物纳米颗粒。你可以把LEVA想象成一种 “生物光刻” 技术,它能像光刻机在芯片上刻蚀电路一样,用光在玻璃表面上“刻”出精确的生物分子图案。
纳米“光刻”的魔术:从疏水到亲水
整个LEVA图案化的过程,主要涉及以下几个关键步骤:
首先,研究人员将处理过的玻璃盖玻片依次涂覆上三层“魔法”材料:聚-L-赖氨酸(PLL) 、甲氧基聚乙二醇琥珀酰亚胺戊酯(mPEG-SVA) ,以及一种名为PLPP的光活化剂。其中,PLL是一种带正电荷的聚合物,是最终吸附EVP的“诱饵”;而mPEG-SVA则是一种具有很强抗粘附性(疏水性)的材料,它能像“不粘锅”涂层一样,阻止EVP的非特异性吸附。
魔法的关键在于紫外光(UV) 。通过一个数字微镜器件(DMD)光学模块,研究人员可以像投影仪一样,将任何想要的图案(如圆形、星形、梯度条)转化为高分辨率的UV光。当UV光照射到涂层表面,就会触发光裂解反应,选择性地将光照区域的mPEG分子链切断并去除。
这就好比掀开了一层“不粘锅”涂层,暴露出了下方的PLL“诱饵”。光照强度越大(在模板中表现为白色/灰色区域),去除的mPEG就越多,暴露的PLL就越多,从而形成明确的、带有正电荷的EVP吸附区域。未被光照的黑色区域则保留完整的mPEG涂层,保持低非特异性结合的状态。
颗粒“寻踪”:尺寸与电荷的拉力赛
图案化完成后,研究人员将EVPs溶液加入。由于大多数EVs带负电荷,它们会被UV光诱导产生的正电荷PLL区域所吸引,并快速、非特异性地吸附到这些预设的图案上。整个过程是非特异性的,这意味着它不需要昂贵的抗体或特异性配体。
通过高分辨率的全内反射荧光显微镜(TIRFM) 成像和COMSOL多物理场仿真,研究团队深入分析了EVP的吸附动力学。结果揭示了一个关键的物理学规律:EVP的尺寸和电荷,是决定其吸附效率和速度的决定性因素。
相比于大EVs(lEVs,平均直径约 nm),小EVs(sEVs,平均直径约 nm)表现出更高的粒子结合能力和更快的动力学。sEVs更快的结合速率主要归因于它们更小的尺寸导致的更强的布朗运动(随机移动),以及更负的表面电荷(sEVs为 mV,lEVs为 mV)。
划重点: sEVs大约只需要8秒就能充分结合到正电荷表面,而lEVs则需要大约58秒。这意味着LEVA对sEVs的吸附效率比lEVs提高了近6倍! 这种差异表明,通过精确控制EVP的尺寸和表面电荷,可以优化甚至选择性地图案化不同亚群的EVPs。
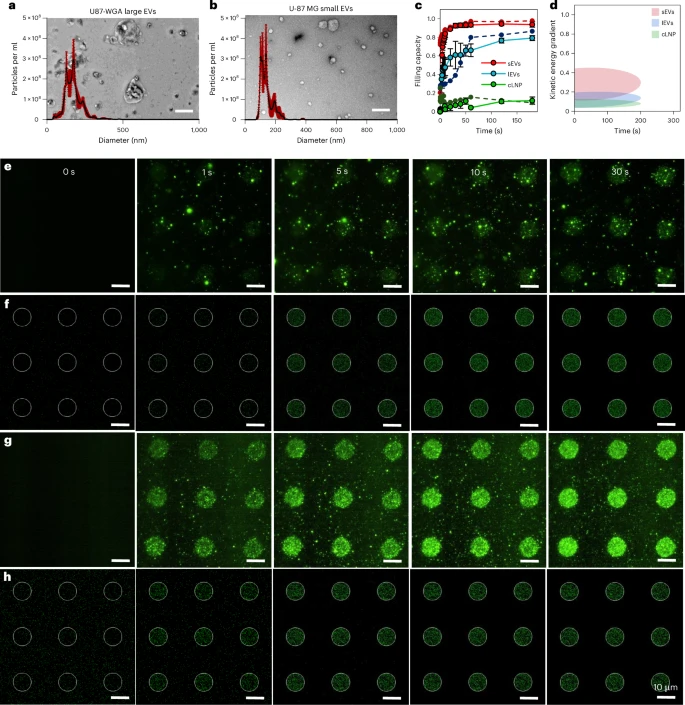
📈 数据背后的创新与颠覆性:精度与功能的新标杆
LEVA技术的突破性,不仅仅在于其优雅的物理机制,更在于它在分辨率、可调性和实际应用上的巨大提升,远远超越了现有技术。
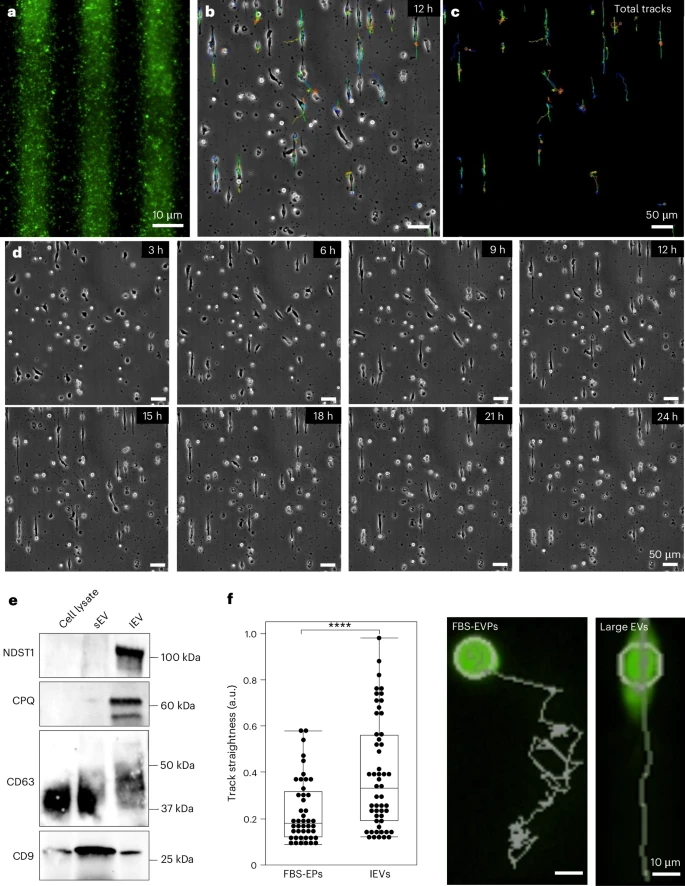
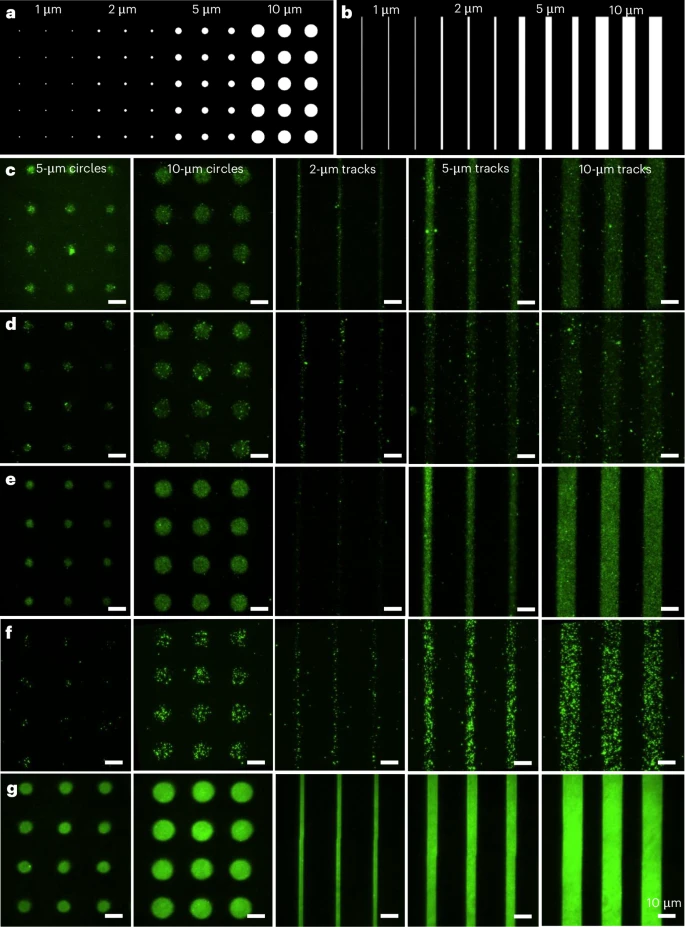
1. 亚微米级分辨率与高保真度
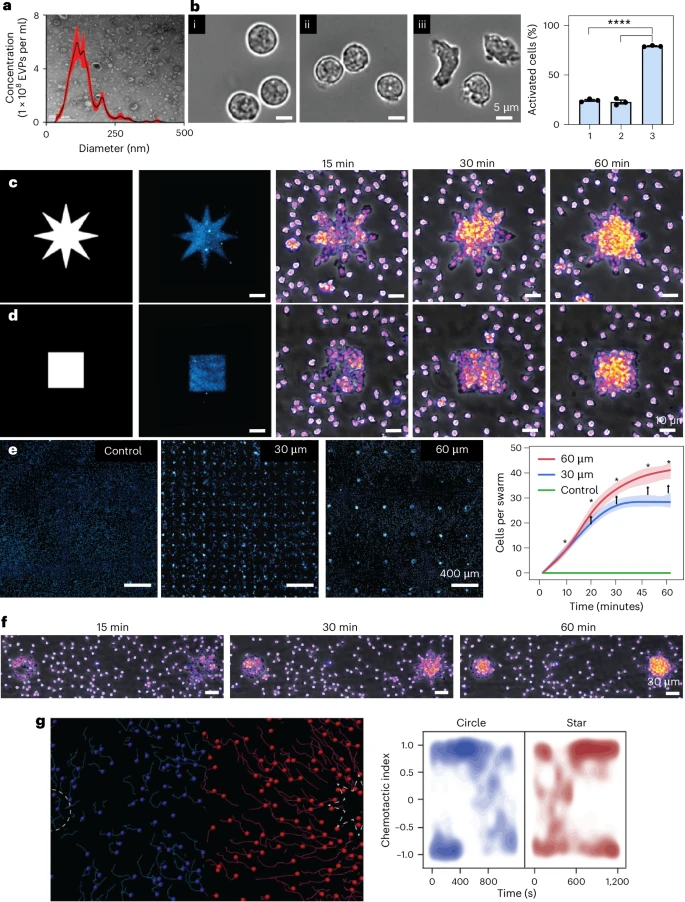
LEVA实现了接近单EV分辨率的图案化。在分辨率测试中,该技术能够一致且成功地图案化5微米和10微米直径的圆形,以及2微米、5微米和10微米宽度的微轨道。虽然1微米图案仍有挑战,但接近单细胞水平(几十微米)或细胞器水平(几微米)的图案精度,使得研究人员可以前所未有地精确控制EVPs在体外微环境中的分布。
此外,该技术展现了极高的图案保真度。通过扫描电子显微镜(SEM)图像进一步证实,EVs的吸附完全符合预期的微图案,在非目标区域的非特异性结合极少,低于6%。这种高保真度是进行高精度单颗粒分析的先决条件。
2. 梯度图案化:从“开/关”到“连续可调”
LEVA最强大的功能之一是其可调性,特别是梯度图案化(Digital Titration) 。利用DMD光刻的灰度图像,LEVA能够创建出线性、指数衰减和高斯分布等多种梯度图案。这相当于实现了EVP表面密度的数字化精确滴定,为构建模仿体内EVP浓度梯度的复杂微环境提供了可能。
关键数据对比:
梯度测试结果表明,sEVs(如U-87 MG sEVs)的图案拟合度始终优于lEVs(如U-87 MG lEVs)。例如,在线性梯度中,sEVs的Spearman's系数高达,而lEVs为。虽然两者都表现出极高的相关性,但sEVs的优异表现再次印证了其尺寸和电荷带来的更高灵活性,使其图案化结果与模板匹配度更高。这种精确的密度控制对于单EV荧光成像和荧光共定位研究至关重要。
3. 功能性突破:模拟癌症转移与免疫风暴
LEVA技术最大的颠覆性体现在其功能性应用的实现上,这是现有技术难以匹敌的:
A. 模拟迁移体“面包屑踪迹”
研究人员利用LEVA技术,精确地“印刷”出了迁移体模拟踪迹(migrasome-mimetic trails)。在这些10微米宽的“踪迹”上,U-87 MG胶质母细胞瘤细胞表现出显著的一维定向迁移行为。与随机移动的FBS-EVP(胎牛血清-EVP)对照组相比,细胞在模拟踪迹上的迁移轨迹直线性显著增高()。这首次提供了一个可扩展、高可控的体外平台,用以研究基质结合型EVP如何指导细胞迁移,对于理解癌症转移路径具有里程碑意义。
B. 细菌EVP诱导的中性粒细胞“蜂群效应”
LEVA首次实现了纯粹由细菌EVs介导的中性粒细胞“蜂群效应”(Neutrophil Swarming)的图案化研究。中性粒细胞是免疫系统的急先锋,在感染或损伤部位表现出集体定向迁移,即“蜂群”行为。研究表明,表面结合的大肠杆菌(E. coli)EVs能够有效激活中性粒细胞(激活率高达近80%),并引发精确的“蜂群”聚集。
通过在同一微区域内图案化面积相等的圆形和八角星形EVP图案,研究人员观察到了中性粒细胞的竞争性迁移。尽管面积相同,但中性粒细胞的趋化指数(Chemotactic Index,反映方向性)显示,部分细胞在一段时间后从圆形图案转向了星形图案。这不仅证明了LEVA能用于研究复杂免疫细胞行为,更暗示了EVP图案的几何形状对细胞趋化行为有微妙且重要的影响。
🌐 应用展望、局限性与未来路线图
LEVA作为一种强大的新工具,其潜力远超目前展示的应用。
在应用展望方面,LEVA将极大地推动我们对“基质结合型EVP”功能的研究。它不仅能用于单EV的分子内容表征、数字滴定和荧光共定位,还能与基底膜蛋白(BMP)、纤维连接蛋白(FN1)等ECM蛋白进行共图案化。这使得研究人员可以构建出更接近体内环境的生物拟态(biomimetic)微环境,用于药物筛选和再生医学。此外,它还能与其他技术(如AFM、TEM、SEM)结合,作为一种通用的非光学EVP样品制备工作流程。
然而,这项技术也存在局限性。
首先是对EVP制备的极高要求。由于LEVA的吸附是非特异性的,任何可溶性蛋白质或游离染料污染物都会被吸附到图案化的表面上,从而混淆EVPs的真实功能。这要求研究人员必须严格遵循EVs的隔离、表征和标记的MISEV2023指南。其次,LEVA主要适用于半透明且相对平坦的二维表面,虽然可以应用于薄水凝胶层表面,但要在三维材料内部图案化EVs可能需要不同的方法。最后,虽然COMSOL模拟结果令人鼓舞,但底层吸附动力学模型仍需扩展,以纳入更复杂的因素,如脂蛋白污染和EV冠(EV corona)的变化。
未来路线图将集中在以下几个方向:
优化生物拟态: 针对特定应用(如迁移体),优化表面工程和EV分离流程,确保EVP形态和功能最大程度地反映其自然状态。
多功能整合: 将LEVA平台整合到微流控和生物微机电系统(bioMEMS)设备中,以引入动态流体条件,从而更好地模拟体内的生理环境。
拓展免疫学研究: 利用LEVA平台研究更多免疫细胞-EVP的相互作用,例如,深入理解生物膜释放的EVs如何影响中性粒细胞等免疫细胞。
总之,LEVA技术的出现,以其高分辨率、高保真度、可调控的梯度制造能力,特别是对sEVs结合速率近6倍的提升,为研究细胞外囊泡在生命活动和疾病中的功能,提供了一个前所未有的强大平台。它不仅是技术上的突破,更是开启了“基质结合型EVP”功能研究的新时代。